Para la aprobación de la Soja Intacta en los países de Argentina, Uruguay y Brasil, Monsanto presento ante los órganos competentes tres estudios de laboratorio en roedores para la evaluación de riesgos sobre toxicidad aguda, crónica y carcinogénesis. En Argentina, el CELMA tuvo acceso a esos ensayos de laboratorio, tras una orden judicial; lo que […]
Para la aprobación de la Soja Intacta en los países de Argentina, Uruguay y Brasil, Monsanto presento ante los órganos competentes tres estudios de laboratorio en roedores para la evaluación de riesgos sobre toxicidad aguda, crónica y carcinogénesis.
En Argentina, el CELMA tuvo acceso a esos ensayos de laboratorio, tras una orden judicial; lo que le permitio realizar un analisis y control de los mismos. Ante todo debe señalarse que no existen standares internacionales obligatorios para los estudios de laboratorio con roedores sobre toxicidad crónica, aguda y carcinogenicidad de los Organos Vegetales Modificados Genéticamente (OVGM). Por lo general los laboratorios y científicos deben ajustar su proceder con las buenas prácticas de laboratorio (BPL) a fin de que sus trabajos puedan ser considerados validos como asi tambien los procedimientos aplicados.
En ese sentido la OCDE, Organización para la Cooperación y el Desarrollo Económico (OCDE) fue creando en general directivas sobre estudios de toxicidad cronica y aguda, que con el tiempo fueron adquiriendo importancia; y hoy sus pautas si bien no son obligatorias, se han transformado en referencias validas aceptadas mundialmente e insertadas como premisas de BPL.
La OCDE es una organización de cooperación internacional, compuesta por 34 países (Argentina no es miembro, pero en el año 1997 adhirió a la declaración sobre inversión internacional y empresas multinacionales).
Por nuestra parte conservamos una mirada crítica sobre la OCDE, ya que por años ciertas pautas impartidas por el organismo han beneficiado solapadamente a las industrias alimenticia y biotecnologica, estableciendo normas laxas y flexibles sobre toxicidad cronica en los ensayos de laboratorio, acomodadas a las necesidades de dichas industrias y en detrimento de una mirada prudente y precautoria que exige el establecimiento de normas cuyo objeto sea la proteccion de la salud humana.
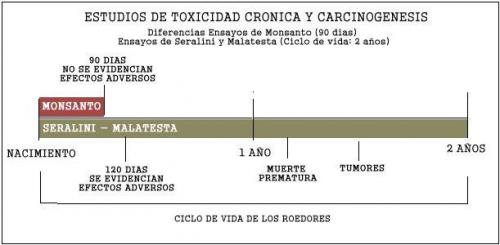
En efecto, durante muchos años para los estudios de toxicidad crónica, las industrias alimenticia y biotecnologica utilizaron para sus ensayos de laboratorio la Directiva 408 de la OCDE. Dicha directiva establecia para los estudios de toxicidad crónica el escaso plazo de 90 días.- Es dable recalcar que la toxicidad cronica refiere a la contaminacion que se produce por consumir un producto en pequeñas dosis durante tiempos largos y cuyos efectos pueden evidenciarse despues de muchos años, por lo tanto, los diseños de ensayos deben comprender un lapso considerable del ciclo de vida de los animales de laboratorio. Siendo que los roedores tienen un ciclo de vida de 24 meses promedio (730 dias), considerar solo 90 dias (no mas del 15 %) del ciclo de vida del animal para analizar los riesgos de toxicidad cronica, es absolutamente insuficiente.
Esto ultimo quedo evidenciado en las conclusiones de algunos estudios de toxicidad cronica a largo plazo (ciclo de vida de los animales roedores -2 años- ) sobre los OVGM realizados por investigadores científicos europeos, que demostraron que a partir del 4 mes (120 dias) se observaron efectos adversos. Con ello quedo clara la laxitud de las normas de la Directiva 408 de la OCDE al fijar un plazo exiguo de 90 dias, generando una fuerte incertidumbre cientifica sobre la inocuidad alimentaria de los productos aprobados con aquella directriz.
Séralini et al., 2008
Autores: G.-E. Séralini, D. Cellier, JS deVendômois Un nuevo análisis de un estudio de alimentación de ratas con unmaíz modificado genéticamente revela signos de toxicidad hepatorrenal Publicadoen Arco. Environ. Contam. Toxicol., 52 (2007), pp 596-602 Experimentos más largos son esenciales para indicar la verdadera naturaleza y el alcance de laposible patología, con los datos actuales no se puede concluir que el maíz transgénico MON863 es un producto seguro.
Link: http://www.ncbi.nlm.nih.
gov/pubmed/17356802 Malatesta et al., 2008 Autores: M. Malatesta, F. Boraldi, G.Annovi, B. Baldelli, S.Battistelli, M. Biggiogera, D. Quaglino Un estudio a largo plazo e ratoneshembras alimentadas con una soja modificada genéticamente: efectos sobre elenvejecimiento del hígado Publicado en Histochem.Cell Biol..,130 (2008), pp 967-977 Resumen: Este estudio de muestra que la ingesta de soja GM puede influir sobre algunas de las características del hígado durante el envejecimiento y, aunque los mecanismos siguen siendo desconocidos,subraya la importancia de investigar las consecuencias a largo plazo deGM-dietas y los posibles efectos sinérgicos con el envejecimiento, xenobióticos y / o condiciones de estrés. LinK: http://www.ncbi.nlm.nih.
gov/pubmed/18648843
Ante las conclusiones de dichos estudios, la OCDE en el año 2009 se vio obligada a dictar nuevas directivas (452 Y 453) sobre estudios de toxicidad crónica y carcinogenicidad previendo plazos de 365 y 730 días respectivamente y fijando que los ensayos deberán ser diseñados en una base de caso por caso.
Monsanto Argentina SAIC para la aprobación del evento Soja Intacta en Argentina presentó a los efectos del análisis de toxicidad crónica y cancigenorecidad dos ensayos:
1) estudio de Alimentación de 90 días, de ratas alimentadas con comida de soja resistente a insectos MON89788


2) estudio de Alimentación de 90 días, de ratas alimentadas con comida de soja resistente a insectos MON87701 89788



Como se observa claramente en los documentos adjuntados, Monsanto no presentó un estudio de toxicidad crónica y carcinogenicidad que comprenda integramente el evento SOJA MON89788 x MON87701 asimismo lo hizo en plazos cortos de 90 dias.
Caso por Caso
Monsanto sobre la Soja Intacta presento estudios de los eventos apilados MON89788 y MON87701 en forma individual con un detalle grave en uno de ellos, en el evento MON 87701 (Resaltado) refiere a otro eventos distintos, primero 89024, luego a 88017 y por ultimo 89034. Lo cual muestra una clara incongruencia del documento y una falta absoluta de control por el organo tecnico SENASA (en materia de inocuidad alimentaria) en el procedimiento administrativo de aprobacion en la Argentina.
La OCDE 453 TG es clara en el Punto 4 al señalar que «los estudios deberán ser diseñados en una base de caso por caso». La EFSA siguiendo los pasos de la OCDE 453 TG, recomendó en su informe científico que la decisión de realizar estudios de toxicidad y/o carcigonecidad con alimentos integrales para consumo humano / animal se debería tomar sobre una base de caso por caso. Se debería basar en la evaluación de toda la información disponible sobre los alimentos integrales para consumo humano / animal resultante de análisis composicionales y otros estudios nutricionales y toxicológicos disponibles.
En tal sentido la Resolución 412/02 establece en el art 7) que se llevará a cabo una evaluación de inocuidad del alimento, siguiendo un método estructurado e integrado que se aplicará caso por caso, con anterioridad a su salida al mercado.
Es importante señalar que aun cuando la norma 7) Resolución 412/02 sea acertada al contener la prevención del caso por caso, es muy laxa al señalar a posteriori que «los datos e informaciones deben estar basados en sólidos principios científicos, obtenidos usando métodos apropiados y analizados mediante adecuadas técnicas estadísticas, debiendo ser de calidad y cantidad suficientes que permitan realizar una evaluación científica»; dado que debió especificar con detalles los métodos apropiados y las adecuadas técnicas estadísticas.
Es cierto que la Argentina no es parte de la OCDE, pero nada impide que una resolución pueda remitir a las directrices de la OCDE TG 453. Ese vacío de la Resolución 412/02 importa una clara desprotección a la salud de los ciudadanos, dado que permite que las empresas realicen los estudios a su arbitrio.
De lo que se observa de los ensayos adjuntados por la empresa Monsanto Argentina SAIC para la aprobacion de la Soja Intacta es que no siguió directrices uniformes en los estudios realizados en forma individual sobre cada evento apilado (en uno lo hizo con cinco grupos de 12/12 con una formulación al 30 % y en el otro evento en tres grupos de 20/20 al 11% y 33 %), lo único que se mantuvo uniforme fue el plazo de duración de los estudios 90 días, ello es, conforme la OCDE 408 (que quedo en desuso en el año 2009), cuando en realidad debió haber aplicado las prescripciones de la OCDE TG 452 y 453.
Plazos largos en los ensayos para analizar riesgos de toxicidad cronica y carcinogeneticos.
Como ya se adelanto, la OCDE 408 fijo las Directrices para los ensayos de productos químicos en roedores de estudios de toxicidad crónica con un plazo de 90 días, que fue modificada en el año 2009 por la OCDE 452 luego integrada a la OCDE 453 TG que fija las directrices para los ensayos de productos químicos en estudios de toxicidad crónica y carcinogenicidad con un plazo de 12 meses (365 días) y 24 de meses (730 días) respectivamente (Los ensayos de Monsanto en el 2010 solo comprendieron 90 dias). Asimismo establece un diseño de 10 roedores de cada sexo por grupo. (Monsanto utilizo 12 en uno y 20 en otro). NADA DE ESTO FUE OBSERVADO POR EL SENASA.
De lo que surge de la documental obrante en las actuaciones administrativas de la Secretaria de Agricultura de la Nación sobre la Soja Intacta, Monsanto Argentina SA realizo la petición de aprobación del evento el 14 Diciembre de 2010, cuando ya regían las directrices de la OCDE 452 y 453.

En cuanto a los estudios sobre toxicidad aguda (proteína CP4 EPSPS) Monsanto presenta un trabajo realizado en el año 1993 por Naylor, en el que se señala las reglas que se siguieron para su desarrollo: se administro como dosis simple por entubación forzada a grupos de diez ratones en dosis de 59, 154 y 572 mg.
Un grupo denominado control de vehículo de 10 ratones/sexo recibió solo la substancia vehículo que consistió en dosis de 33 ml/kg de una solución de bicarbonato de sodio 50MM. otro grupo de control (también denominado control de vehículo en las tablas) de diez ratones/sexo recibió seroalbumina bovina (BSA) a una dosis de 363 mg/kg (tambien a 33,33 ml/KG; dosis objetivo fue de 400 mg/kg)


Que tales parámetros, son absolutamente arbitrarios y no cumplen con ningunos de los protocolos de la OCDE, ni 420,423 y 425 sobre toxicidad aguda.
Las reglas de la OCDE 420 (método dosis fija), Esta Guía está destinada principalmente para su uso con la rata. Los grupos de animales de un mismo sexo (normalmente hembras) se dosifican en una manera gradual las dosis fijas de 5, 50, 300 y 2000 mg / kg (excepcionalmente 5,000 mg / kg). El nivel de dosis inicial se selecciona sobre la base de un estudio preliminar como la dosis espera para producir algunos signos de toxicidad sin causar efectos tóxicos graves o la mortalidad. Otros grupos de animales se pueden dosificar en dosis altas o más bajas, dependiendo de la presencia o ausencia de signos de toxicidad o mortalidad. Este procedimiento continúa hasta que se identifica la dosis que causa toxicidad manifiesta o la muerte, o cuando no hay efectos se ven en la dosis más alta o cuando ocurren muertes a la dosis más baja. La sustancia de ensayo se administra en una dosis única por alimentación forzada mediante sonda gástrica o una cánula de intubación adecuada. Los animales deben estar en ayunas antes de la administración. Un total de cinco animales de un sexo normalmente se utilizará para cada nivel de dosis investigado. http://www.oecd-ilibrary.org/
environment/test-no-420-acute- oral-toxicity-fixed-dose- procedure_9789264070943-en Las reglas de la OCDE 423 deben usarse tres animales para cada paso. Se debe seleccionar el nivel de dosis para ser utilizada como la dosis de partida a partir de uno de los cuatro niveles fijos, 5, 50, 300 y 2.000 mg / kg de peso corporal. La dosis inicial debe ser lo que es más probable para producir la mortalidad en algunos de los animales dosificados. . Cuando la información disponible sugiere que la mortalidad es poco probable en el nivel de dosis más alto de partida (2000 mg / kg de peso corporal), a continuación, debe llevarse a cabo un ensayo límite. Cuando no hay información sobre una sustancia a ensayar, por razones de bienestar animal, se recomienda utilizar la dosis inicial de 300 mg / kg peso corporal. http://www.oecd-ilibrary.org/
docserver/download/9742301e. pdf?expires=1381156303&id=id& accname=guest&checksum= 3BD0616E6EA6A2BEA888C2D0988A49 44 Las reglas de la OCDE 425. Esta TG está diseñado para su uso con los roedores (ratas hembra preferentemente). Hay una prueba de límite y una prueba principal. El ensayo límite se puede utilizar de manera eficiente para identificar los productos químicos que son propensos a tener baja toxicidad. La sustancia de ensayo se administra generalmente en una dosis única por alimentación forzada a animales en ayunas antes de la dosificación. Animales individuales se dosifican en secuencia por lo general a intervalos de 48h. El primer animal se dosifica un paso por debajo de las mejores estimaciones preliminares de la DL50.El segundo animal recibe una dosis más baja (si el primer animal muere) o una dosis más alta (si el primer animal sobrevive). Los animales se observan con una atención especial durante las primeras 4 horas y diariamente a partir de entonces, para un total de 14 días en general. http://www.oecd-ilibrary.org/
environment/test-no-425-acute- oral-toxicity-up-and-down- procedure_9789264071049-en
Que la Resolución 402/12 al no fijar que directrices deben seguirse, ni el SENASA haber recepcionado los importantisimos cambios relacionados con los ensayos de toxicidad cronida y carcinogenicidad en laboratorio, ni reparado en las inoberservancias en los ensayos de toxicidad aguda permite el obrar arbitrario de las empresas solicitantes.
Es decir, el SENASA no dio cuenta de las directrices de la OCDE TG 420, 423, 425, 452 y 453, tampoco realizo observación alguna convalidando los ensayos presentados por Monsanto (realizados conforme reglas elegidas a su arbitrio) y a su vez no considero la información científica de los estudios de otros investigadores (como los citados mas arriba) que siguiendo un procedimiento cientifico adecuado (ensayos a largo plazo) los resultados indican la existencia de riesgos concretos a la salud humana de los OVGM.
A ello se suma la imposibilidad de la comunidad en general de poder participar en un proceso de consultas o audiencias publicas dentro del procedimiento administrativo de aprobación de los OVGM, a los efectos de presentar las objeciones fundadas en los estudios que develan la existencia de riesgos, para que sean considerados por la autoridad de contralor en biotecnología al momento de dictar la resolución administrativa pertinente.-
Conclusiones
La OCDE creo directrices más rigurosas a través de la normas OCDE 452,453 sobre los estudios de toxicidad crónica y carcinogenicidad . Asimismo la EFSA, autoridad de seguridad alimentaria de Europa dio cuenta de ello y publico un reporte en Julio de 2013 en la cual fija recomendaciones para los mismos estudios remitiendo a la OCDE 453.
Sobre esto ultimo, la EFSA fue determinante «los parámetros a considerar tanto para la fase de toxicidad crónica como la para la fase de carcinogenicidad deberían estar en línea con los detallados en la OECD TG 453. Se deberían considerar marcadores adicionales de efectos nutricionales y/o metabólicos potencialmente adversos sobre una base caso por caso, de acuerdo con el conjunto de evidencia disponible y el tipo de alimentos integrales para consumo humano/animal que se están investación». Asimismo agrega que debería incluirse un capitulo especifico sobre el análisis de las suposiciones eincertidumbres.
Que tales nuevas reformulaciones (tanto de la OCDE en el año 2009 y la EFSA en el 2013) importan un cambio transcendental en los análisis de riesgos de los OVGM. Ese cambio pasó absolutamente inadvertido por las autoridades argentinas en materia de biotecnología como los órganos técnicos (SENASA – CONABIA). El SENASA (No asi la CONABIA -Res.701/11-) esta obligada por la Resolución 412/02 a recepcionar e incorporar la nueva información científica que surja en relación a la evaluación de riesgos de los OVGM a fin de adaptar las medidas de gestión de riesgos.
El art 15) de la Resolución 412/02 es claro en ese sentido:
«Teniendo en cuenta el rápido desarrollo de la biotecnología se revisará, cuando sea necesario, el criterio de evaluación de inocuidad aplicado a los alimentos obtenidos por medios biotecnológicos modernos, para asegurar que la información científica más reciente se incorpore al análisis de riesgos. Cuando se obtenga nueva información científica de interés para la evaluación de riesgos, esta última se revisará para incorporar la información en cuestión y, de ser necesario, se adaptarán en consecuencia las medidas de gestión de riesgos.»
Asimismo la Resolución 412 /02 obliga a un reexamen de la evaluación de inocuidad frente a las nuevas informacionescientíficas que pongan en tela de juicio las conclusiones de la evaluación original.
El Art 52) de la Res 412/02 tambien es por demas elocuente:
«La evaluación de inocuidad deberár eexaminarse a la luz de las nuevas informaciones científicas que puedan poneren tela de juicio las conclusiones de la evaluación original».
A merito de lo expuesto es inobjetable que los análisis de riesgos de los OVGM (toxicidad crónica y carcigonecidad) deben realizarse por plazos largos (ciclo de vida de los animales de laboratorio). Asimismo los estudios de toxicidad aguda deben adecuarse a las nomas actuales de la OCDE.
Sobre el evento Soja Intacta, la empresa Monsanto eligio pautas para sus ensayos de modo absolutamente arbitrario que están enajenadas de las nuevas directivas de la OCDE 453 (en lo que refiere a toxicidad crónica y carcigenogecidad) y OCDE 420,423 y 425 (en toxicidad aguda). Debe darse relevancia que sobre los efectos cronicos, al soslayar Monsanto las directivas actualizadas de la OCDE, logro ocultar datos que se evidenciaron en estudios a plazos largos (24 meses), generando una incertidumbre cientifica sobre la inocuidad alimentaria de los OVGM aprobados en plazos cortos (90 dias).
Es en base al principio precautorio regulado en el art 4 de la ley general de Ambiente 25.675 que en razón de esa incertidumbre científica y las omisiones manifiestas del SENASA corresponde la adopción de una serie de medidas eficaces oportunas que no pueden postergarse por cuestiones de costos, ello es: 1) la suspensión del evento Soja Intacta por carecer de análisis integral y real sobre su inocuidad alimentaria; 2) la adecuación -por parte del Estado- de las normas de aprobación de las semillas transgénicas a la nueva información científica (Directrices de la OCDE TG 453 y de la EFSA) y 3) obligar -en consencuencia- a las empresas biotecnológicas a que cumplan con las directivas de las pautas de la OCDE en los estudios y ensayos de laboratorio, para así poseer una debida y real garantía de inocuidad alimentaria que hoy conforme esos estándares internacionales, de modo inequívoco carecen.
Centro de Estudios Legales del Medio Ambiente. CELMA
Rebelión ha publicado este artículo con el permiso de los autores mediante una licencia de Creative Commons, respetando su libertad para publicarlo en otras fuentes.


