La sociedad ha interiorizado que existe una relación entre cáncer y metabolismo. Todo el mundo habla de las dietas milagro, las dietas alcalinas, los antioxidantes, la obesidad, el ejercicio, la fibra y un largo etcétera. Los científicos llevan casi 100 años investigando esta relación y ahora ha surgido un nuevo estudio que explica cómo un […]
La sociedad ha interiorizado que existe una relación entre cáncer y metabolismo. Todo el mundo habla de las dietas milagro, las dietas alcalinas, los antioxidantes, la obesidad, el ejercicio, la fibra y un largo etcétera. Los científicos llevan casi 100 años investigando esta relación y ahora ha surgido un nuevo estudio que explica cómo un gen regulador del metabolismo lo es también del cáncer. En este texto intentaremos resumir las claves de este descubrimiento y su relación con el cáncer de próstata.
Otto Warburg fue un fisiólogo alemán que ganó el premio Nobel de medicina en 1931 por sus estudios del metabolismo tumoral. Él descubrió que los tumores eran más glicolíticos que los tejidos sanos, lo que quiere decir que en vez de metabolizar la glucosa oxidándola lo hacen mediante una especie de fermentación, la glicólisis. Es lo que hacen los músculos cuando les falta oxígeno. Durante la glicólisis se produce lactato, en vez de dióxido de carbono y agua. El lactato es ácido y por eso los tumores lo expulsan. Por ello los tumores sólidos están en un ambiente ácido. Esta característica ha dado pie a la creencia de que la acidez es protumoral, y que, por tanto, las dietas alcalinas protegerían del cáncer. Esta teoría es falsa por la sencilla razón de que la acidez del entorno tumoral es consecuencia de su metabolismo y no causa del tumor.
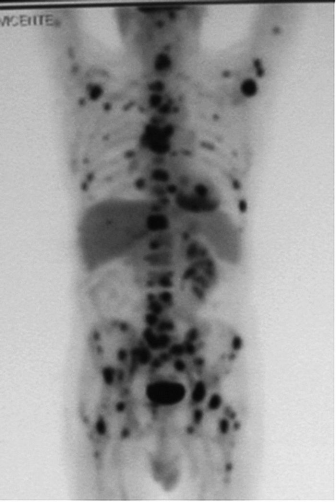
Además, Otto observó que las células tumorales no sólo metabolizaban la glucosa de manera particular, sino que utilizaban más cantidad que las células, digamos, normales. Esto se utiliza en la actualidad para el diagnóstico con la técnica del PET (Figura 1)
 .
.
Warburg era tan importante que pedía el dinero al gobierno alemán como podéis ver en la foto: «Necesito 10000 marcos». En la actualidad eso sería impensable, se necesita escribir largos y, a menudo, tediosos proyectos para que financien la investigación. Fue tan relevante que al fenómeno por el que las células tumorales son más glicolíticas se le llamó Efecto Warburg.
Durante décadas, el metabolismo tumoral quedó un poco aparcado, aquello de la glicólisis era un fenómeno descriptivo y no se le vieron aplicaciones terapéuticas más allá del PET. Sin embargo, en la última década ha habido una explosión de publicaciones que estudian el metabolismo de las células cancerígenas.
Pero, ¿de qué hablamos cuando decimos metabolismo celular?
Todos entendemos que, cuando nos alimentamos nuestro organismo digiere, procesa y, finalmente, transforma los nutrientes en energía y materia viva. También sabemos que hay tres nutrientes esenciales: azúcares, proteínas y grasas.
A nivel celular se produce un proceso parecido, pero no igual. Es por esto por lo que mucha gente se confunde y cree que si los tumores son ávidos en glucosa (un componente del azúcar), comer demasiada azúcar es cancerígeno. Y no. No, porque a las células llegan los nutrientes muy procesados y en sus formas más simples: glucosa, aminoácidos y ácidos grasos o colesterol. Y la cantidad que entra a las células está muy bien regulada, no cogen todo lo que hay a su alrededor, sino lo que necesitan.
El metabolismo celular se regula de manera que el tipo de nutriente y cómo lo utiliza sea lo más eficiente posible. Estos nutrientes los «quemará» para producir energía (catabolismo) y los transformará en «bio-ladrillos» para crear nuevas células o estructuras celulares (anabolismo). Así, una célula muscular que necesite mucha energía durante mucho tiempo utilizará los ácidos grasos, mientras que una célula inmunológica que tenga que replicarse miles de veces en pocas horas utilizará principalmente la glucosa puesto que se metaboliza más rápidamente y se puede transformar en «bio-ladrillos».
Cáncer y metabolismo
El cáncer es un proceso que deriva de la vida. Se tiene cáncer porque se vive. Es así de paradigmático. Millones de personas lo sufren y muchas más lo temen. Pero al final, no es otra cosa que partes de nuestro cuerpo viviendo «demasiado». El proceso tumoral, por el que las células normales se dividen sin control, invaden y migran a otros tejidos necesita de muchos desequilibrios, inducidos generalmente por mutaciones o alteraciones en la información genética. No hace mucho que nos hemos dado cuenta de que había un denominador común en esas alteraciones: el metabolismo. A esto se le denomina re-programación metabólica, lo que facilita a las células priorizar la síntesis de bio-ladrillos sin descuidar la producción de energía y el potencial anti-oxidante. Básicamente adaptar el uso de los nutrientes a sus «nuevas» necesidades bioenergéticas.
Esa reprogramación tiene que estar controlada a nivel genético. Pero como son tantos los procesos que están alterados, es difícil entender cómo se pueden dar tantas mutaciones en esos genes de los tumores. Algo difícil de explicar por la teoría darwiniana de la selección de mutaciones aleatorias.
Unos investigadores han dado en el clavo: los reguladores maestros. Imaginaos una llave maestra o el gerente de un almacén, si fallan, falla todo el proceso; mientras que si falla un operario aún puede funcionar el almacén. Recientemente se ha publicado un artículo en NCB que describe cómo un gen, PGC1alpha, suprime la actividad tumoral. Estos investigadores han descubierto que este regulador maestro está casi ausente en los cánceres de próstata y aún más en las metástasis.
¿Os acordáis de Lorea Valcárcel? Le hicimos una entrevista, ella es una de las autores principales de este estudio.
Vídeo Lorea Valcárcel Trabaja en metabolismo del cáncer
Pues PGC1alpha es un viejo conocido, un regulador maestro del metabolismo, que se activa cuando tenemos frío para calentarnos quemando grasa parda, o que nos permite correr maratones aumentando las mitocondriasi de nuestros músculos y haciendo que quememos más grasa. Lo que han descubierto estos investigadores es que este regulador maestro está casi ausente en los cánceres de próstata y aún más en las metástasis.
Así, tenemos un regulador de reguladores que está en la cima de la pirámide del metabolismo y es responsable de la producción de energía. Además, su presencia es fundamental para que un tumor de próstata no evolucione hacia una metástasis maligna.
El proceso
¿Y cómo han averiguado esto los investigadores?
1º Han analizado la expresión de este gen en bases de datos de cánceres de próstata. Cada vez que se le hace una biopsia a un paciente, esta se analiza. La expresión de decenas de miles de genes se compara con la de otros miles de pacientes. Así, tenemos acceso a un mapa de expresión de tumores primarios, metástasis, etc. En este estudio han visto que este gen, PGC1alpha, está muy disminuido en los tumores y además su ausencia está asociada con una mayor probabilidad de recaída. Pero claro, esto no quiere decir que la ausencia de este factor sea un requisito imprescindible para el tumor, puede ser una consecuencia del mismo proceso tumoral.
2º Para averiguar esto le han quitado a ratones predispuestos a cáncer de próstata ese gen. Mediante ingeniería genética han eliminado este gen en la próstata de ratones transgénicos que desarrollan cáncer de próstata a partir de los 6 meses de edad. Los investigadores vieron que en los ratones sin PGC1alpha no solo se acelera la progresión tumoral, sino que además sufren metástasis, algo que nunca pasa en estos ratones.
En este momento podemos decir que la falta de ese gen hace al tumor más agresivo, pero no sabemos cómo.
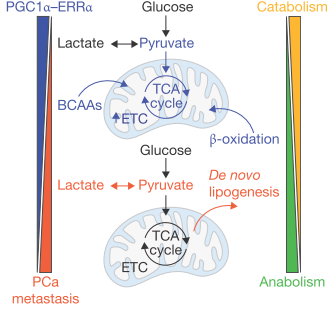
3º Para esto, cogieron líneas celulares humanas de metástasis de cáncer de próstata que, como era de esperar, no expresaban ese gen y se lo introdujeron. Así vieron dos cosas, que esas células crecían menos, tenían menos agresividad y menos capacidad de metastatizar y de manera importante vieron que, expresar ese regulador maestro, revertía esa reprogramación metabólica de la que hablábamos. Esas células metastáticas sin PGC1alpha que son glicolíticas y utilizan los nutrientes para sintetizar bio-ladrillos cuando se les fuerza a expresar el regulador maestro, revierten su metabolismo a uno más oxidativo y se hacen menos metastáticas (Figura 2).
Figura 2. Este dibujo, tomado de aquí, representa cómo un aumento en la expresión de PGC1alpha (y su compañero ERRa) corresponde con un estado metabólico catabólico (en azul), donde se utilizan ácidos grasos y glucosa en la mitocondria para la producción de energía. Mientras que bajos niveles de expresión de PGC1alpha (en rojo) corresponden con un estado anabólico que dedica la glucosa para la síntesis de ácidos grasos, más ventajoso para la célula tumoral.
Moraleja
El cáncer de próstata avanzado apenas tiene tratamiento. No entendemos por qué algunos progresan de manera muy agresiva y otros (la mayoría por suerte) se quedan en ese estado latente durante toda la vida del hombre. Los investigadores creen que sería posible hacer un análisis genético del tumor para predecir si el tumor progresará o no en base a la expresión de ese regulador maestro. Además, según el patrón de expresión, el tumor será sensible a unos fármacos u otros. Esto es lo que se viene llamando «medicina de precisión».
Por otro lado, este estudio confirma que el estado metabólico más oxidativo impide al cáncer de próstata progresar.
Aquí es cuando nos viene a la mente una hipótesis bonita pero improbable. ¿Si estimulamos la expresión de PGC1alpha podremos prevenir el cáncer de próstata? Se sabe que hacer ejercicio y cultivar un estado catabólico general aumenta los niveles de PGC1alpha y que esto es positivo para la salud. Lo contrario también es cierto, el estilo de vida occidental, «macdonalizado», aumenta el riesgo de sufrir cáncer de próstata. Sin embargo, es arriesgado afirmar que la acción preventiva y saludable del ejercicio físico sea a través del regulador maestro, ya que las células tumorales pueden sufrir alteraciones genéticas que inactivan la expresión de genes que no le son ventajosos, incluido PGC1alpha. Y esto es independiente del estado de este regulador en el organismo.
Otra cosa que muestra esta investigación es que lo que vale para un tipo de tumor puede no valer para otro. En el caso del melanoma, PGC1alpha se comporta como un oncogén, es decir, que su presencia ayuda al cáncer a progresar, ¡al contrario que en el cáncer de próstata! Por eso no hablamos de una sola enfermedad y tenemos que entender cada tipo de cáncer para poder afrontar su tratamiento.
Hagan ejercicio, coman bien y si pueden den paseos con el frío, pero sobre todo entiendan que con el cáncer no hay milagros, confíen en su oncólogo y apoyen la investigación biomédica.
i Las mitocondrias son como las centrales energéticas de nuestras células. Queman los nutrientes para transformarlos en energía y CO2.
Fuente: https://cienciamundana.wordpress.com/2016/06/19/los-maestros-del-metabolismo-tumoral/