Muchos países han comenzado un programa de inmunización, poniendo las vacunas de ARN mensajero (ARNm) en el centro de atención.
Tan solo 66 días separan la secuenciación del genoma del SARS-CoV-2 del primer ensayo clínico. Este rápido desarrollo y alta eficacia (95%) han planteado preguntas sobre el mecanismo de funcionamiento de estos productos.
El ARN mensajero de las vacunas de Moderna y BioNTech/Pfizer porta la información necesaria para fabricar la proteína de la espícula S (spike) del coronavirus SARS-CoV-2 y así activar la respuesta inmune. La elegancia de este método consiste en que no se necesitan cultivos de células para producir virus atenuados o grandes factorías para sintetizar y purificar proteínas víricas. Este trabajo laborioso se desarrolla con la maquinaria de la propia célula. El código genético es la “piedra Rosetta” que hace posible traducir una secuencia de ARN mensajero en una proteína.
Sin embargo, el ARN mensajero es una molécula frágil de corta duración. Se degrada en las células humanas en un promedio de 10 horas y es destruido por enzimas ribonucleasasas. Entonces, ¿cómo es posible que el ARN mensajero se pueda usar como vacuna si nada más entrar en nuestro cuerpo es destruido por nuestras defensas?
El éxito de las vacunas de ARN mensajero es el fruto de la investigación básica que se ha ido acumulando durante más de tres décadas. Entre los numerosos avances que han posibilitado este hito científico caben destacan dos: la capacidad de sintetizar ARN modificado y el mecanismo de transporte a la célula.
ARN mensajero síntetico: instrucciones para crear proteínas
Los mecanismos celulares para reconocer y destruir material genético extraño han sido perfeccionados durante millones de años de evolución. Ha requerido tiempo e ingenio de investigadores como Kerikó y su colega Weissman para llegar a una receta que esquive la degradación del ARNm. Estos demostraron en 2005 que, modificando uno de los componentes del ARNm, se podía aplacar a las defensas contra el ARN sintético.
La vacuna contiene ARNm con una tapa inicial y una cola larga de poliadenina en la parte posterior para que sea reconocida como ARNm dentro de la célula. Además, se usa una forma modificada de uracilo (U) –una de las cuatro bases nitrogenadas que forman parte del ARN– para escapar de las defensas que ayudan a protegernos del ARN foráneo. Por ejemplo, en la vacuna COVID-19 BioNTech/Pfizer, cada U ha sido reemplazada por pseudouridina, denotado por Ψ en la secuencia publicada por la OMS.
Esta ingeniosa bioingeniería garantiza que el ARNm se procese correctamente dentro de la célula, se traduzca en proteína (curiosamente con mayor capacidad), se exponga en la membrana celular y desencadene la respuesta inmune contra el virus (ver Figura 3).
Cuando el ARN sintético es traducido y la proteína de espícula es producida en las células humanas, esta proteína muestra una conformación diferente a la del coronavirus. Gracias al conocimiento adquirido sobre otros coronavirus (MERS, SARS) y la estructura publicada de la proteína de espícula, el ARNm de la vacuna contiene dos pequeñas modificaciones para que la proteína adquiera una conformación rígida que se asemeje a la proteína de espícula real del virus. A medida que se identifican variantes mutadas del coronavirus, las vacunas de ARNm podrían reprogramarse para abordar rápidamente las cepas emergentes.
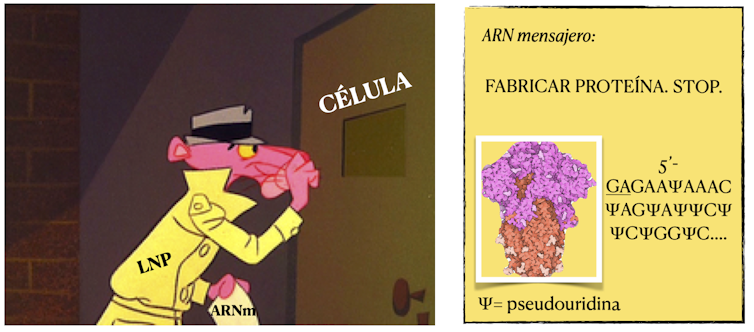
Figura 1 El ARN mensajero es transportado por una nanopartícula lípidica (LNP) que atraviesa la membrana celular y libera su mensaje para que la maquinaria celular sintetice la proteína de la espícula del virus SARS-CoV-2. El mensaje está modificado para que no sea reconocido como extraño y no se destruya.
Nanoparticulas lípidicas (LNP): gotas de grasa protectoras
Un método de transporte eficaz es el segundo ingrediente de la vacuna ARNm. Imagine que compra un jarrón de cristal muy frágil por internet. Necesita una buena caja, con espuma para que no se rompa, y la dirección para que llegue a su destino. De manera similar, el ARNm es una molécula muy frágil y se transporta dentro de una esfera o gota de grasa que atraviesa la pared celular por endocitosis y libera su material dentro de la célula (Figura 3).
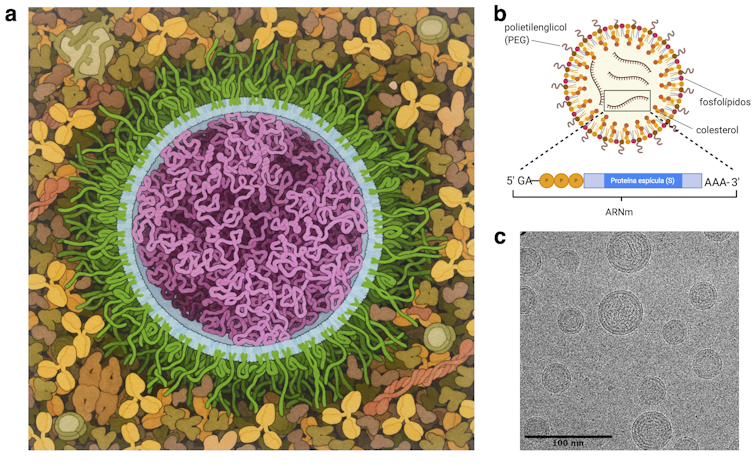
Figura 2.- A) Representación artística de la vacuna ARNm SARS-Cov-2. Nanopartículas lipídicas (LNP) con ARNm (magenta) decoradas en la superficie con (polietilenglicol en verde) rodeado de suero sanguíneo y linfa. Ilustración de David S. Goodsell, RCSB Protein Data Bank; .-B) Esquema de la nanopartícula lipídica usada en BionTech/Pfizer y Moderna. Una mezcla de lípidos cargados, fosfolípidos y colesterol. El ARN mensajero (mRNA) porta la información necesaria para fabricar la proteína de la espícula S (spike) del coronavirus SARS-CoV-2. C) Nanoparticulas lipídicas con RNA observadas por microscopía electrónica criogénica similares a las usadas por Biontech/Pfizer. Imagen .-C extraída con permiso de Kulkarni et al. Copyright (2018) American Chemical Society.
La entrega de ácidos nucleicos a las células ha sido un desafío durante muchas décadas. El primer avance provino del laboratorio de Robert Langer en MIT, quien demostró que ciertos polímeros permitían la liberación gradual de proteínas y otras macromoléculas .
En los años setenta se publicaron estudios mostrando que era posible encapsular ácidos nucleicos en pequeñas vesículas decoradas con el polímero polietilenglicol (PEG) y ralentizar así su degradación. Langer y otros desarrollaron gotas de grasa de varios nanometros, llamadas nanopartículas de lípidos (LNP) que son muy eficaces en el trasporte y liberación de ácidos nucleicos.
En 2010 fundaron Moderna, la compañía que utiliza este método en una de las primeras vacunas de ARNm contra la covid-19 (mRNA-1273). Las LNP se usan en terapias contra el cáncer y no es la primera vez que se autoriza el uso de una vacuna de RNA que usa LNP. En 2018, la FDA autorizó Patisiran, un medicamento para tratar un tipo de amiloidosis hereditaria (una enfermedad rara) usando ARN interferente.
La vacuna de la covid-19 usa nanopartículas lipídicas compuestas de tres ingredientes principales (Figura 2 b): un lípido catiónico ionizante (un lípido con carga positiva), colesterol y PEG. El colesterol asegura la fluidez de la partícula y se cree que aumenta la eficacia con la que el LNP se fusiona con la membrana celular. El polietilenglicol aumenta la potencia de la vacuna al hacer que la partícula hidrófoba sea más soluble en agua y ralentice su degradación. Finalmente, el lípido catiónico ionizante es el elemento clave que facilita la encapsulación de un molécula cargada negativamente como el ARNm.
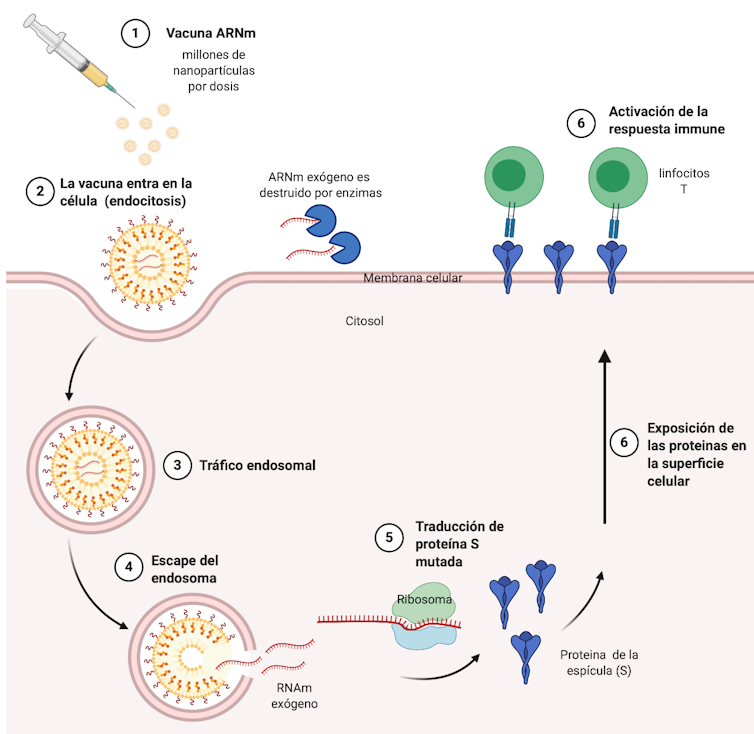
Figura 3. Esquema del funcionamiento de las vacunas ARNm.
Múltiples recetas, diferente estabilidad
BionTech/Pfizer y Moderna usan la misma tecnología para encapsular ARNm en nanopartículas lipídicas. Sin embargo, difieren en la composición de los lípidos que usan. Esto unido a posibles diferencias en la estructura y termoestabilidad del ARNm, hace que Pfizer recomiende la conservación de la vacuna a -70 °C, mientras que Moderna garantiza la estabilidad de la vacuna a -20 °C. Los detalles de la receta para producir LNPs están protegidas por una patente pero se pueden deducir de los informes de autorización de la FDA mRNA-1273 y BionTech/Pfizer BNT162b2 (Comirnaty).
La vacuna de Oxford/AstraZeneca ChAdOx1 usa un adenovirus de chimpancé modificado para trasportar ADN que codifica la proteina de la espícula. Su mecanismo es distinto de las anteriores y se puede conservar a 4 °C.
Estas vacunas son la gran esperanza en esta pandemia y futuras enfermedades, pero también son claro ejemplo de las sinergias entre diversas disciplinas como la biología molecular, la nanotecnología y la ciencia de la materia blanda (soft matter). Una vez más, la ciencia básica proporciona los ingredientes para una revolución tecnológica, como lo son las vacunas ARNm.
Ibon Santiago. Alexander von Humboldt Research Fellow, Technical University of Munich


